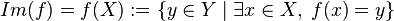Los
hidrocarburos son
compuestos orgánicos formados únicamente por "átomos de
carbono e
hidrógeno". La estructura molecular consiste en un armazón de átomos de carbono a los que se unen los átomos de hidrógeno. Los hidrocarburos son los compuestos básicos de la
Química Orgánica. Las cadenas de átomos de carbono pueden ser lineales o ramificadas y abiertas o cerradas.
Los hidrocarburos se pueden diferenciar en dos tipos que son
alifáticos y
aromáticos. Los alifáticos, a su vez se pueden clasificar en
alcanos,
alquenos y
alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las
fórmulas generales de los alcanos, alquenos y alquinos son C
nH
2n+2, C
nH
2n y C
nH
2n-2, respectivamente.
Clasificación
Según la estructura de los enlaces entre los átomos de carbono, se clasifican en:
- Hidrocarburos alicíclicos, alifáticos, unalifáticos, o de cadena abierta: estos a su vez se dividen en:
- Hidrocarburos saturados (alcanos o parafinas), que no tienen enlaces dobles, triples, ni aromáticos, sólo múltiples enlaces individuales, y de cadena.
- Hidrocarburos no saturados o insaturados, que tienen uno o más enlaces dobles (alquenos u olefinas) o triples (alquinos o acetilénicos) entre sus átomos de carbono.
- Hidrocarburos cíclicos, hidrocarburos de cadena cerrada que a su vez se subdividen en:
QUE SON LOS ALCANOS
Los
alcanos son
hidrocarburos, es decir que tienen sólo átomos de
carbono e
hidrógeno. La
fórmula general para alcanos alifáticos (de cadena lineal) es C
nH
2n+2, y para cicloalcanos es C
nH
2n. También reciben el nombre de
hidrocarburos saturados.
Los alcanos son compuestos formados solo por
átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de
grupos funcionales como el
carbonilo (-CO),
carboxilo (-COOH),
amida (-CON=), etc. La relación C/H es de C
nH
2n+2 siendo n el número de átomos de carbono de la
molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos).
PROPIEDADES FISICAS DE LOS ALCANOS
alcanos experimentan fuerzas intermoleculares de
van der Waals y al presentarse mayores fuerzas de este tipo aumenta el
punto de ebullición además los alcanos se caracterizan por tener enlaces simples.
[3]
Hay dos agentes determinantes de la magnitud de las fuerzas de van der Waals:
- el número de electrones que rodean a la molécula, que se incrementa con la masa molecular del alcano
- el área superficial de la molécula
Bajo
condiciones estándar, los alcanos desde el CH
4 hasta el C
4H
10 son gases; desde el C
5H
12 hasta C
17H
36 son líquidos; y los posteriores a C
18H
38 son sólidos. Como el punto de ebullición de los alcanos está determinado principalmente por el peso, no debería sorprender que los puntos de ebullición tengan una relación casi lineal con la
masa molecular de la molécula. Como regla rápida, el punto de ebullición se incrementa entre 20 y 30 °C por cada átomo de carbono agregado a la cadena; esta regla se aplica a otras series homólogas.
[3]
Un alcano de cadena lineal tendrá un mayor punto de ebullición que un alcano de cadena ramificada, debido a la mayor área de la superficie en contacto, con lo que hay mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compárese el
isobutano y el
n-butano, que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y 2,3-dimetilbutano que hierven a 50 y 58 °C, respectivamente.
[3] En el último caso, dos moléculas de 2,3-dimetilbutano pueden "encajar" mutuamente mejor que las moléculas de 2,2-dimetilbutano entre sí, con lo que hay mayores fuerzas de van der Waals.
PROPIEDADES QUIMICAS DE LOS ALCANOS
En general, los alcanos muestran una reactividad relativamente baja, porque sus enlaces de carbono son relativamente estables y no pueden ser fácilmente rotos. A diferencia de muchos otros compuestos orgánicos, no tienen
grupo funcional.
Sólo reaccionan muy pobremente con sustancias iónicas o polares. La
constante de acidez para los alcanos tiene valores inferiores a 60, en consecuencia son prácticamente inertes a los ácidos y bases. Su inercia es la fuente del término
parafinas (que significa "falto de afinidad"). En el
petróleo crudo, las moléculas de alcanos permanecen químicamente sin cambios por millones de años.
Sin embargo, es posible reacciones redox de los alcanos, en particular con el oxígeno y los halógenos, puesto que los átomos de carbono están en una condición fuertemente reducida; en el caso del metano, se alcanza el menor estado de oxidación posible para el carbono (-4). La reacción con el oxígeno conduce a la combustión sin humo; con los halógenos, a la
reacción de sustitución. Además, los alcanos interactúan con, y se unen a, ciertos complejos de metales de transición (ver:
activación del enlace carbono-hidrógeno).
Los
radicales libres, moléculas con un número impar de electrones, juegan un papel importante en la mayoría de reacciones de los alcanos, tales como el cracking y el reformado, donde los alcanos de cadena larga se convierten en alcanos de cadena corta, y los alcanos de cadena lineal en los isómeros ramificados, respectivamente.
En los alcanos altamente ramificados, el ángulo de enlace puede diferir significativamente del valor óptimo (109,47°) para permitir a los diferentes grupos suficiente espacio. Esto origina una tensión en la molécula conocida como
impedimento estérico, y puede aumentar sustancialmente la reactividad.

El
metano es el primer alcano.
Los
alcanos son
hidrocarburos, es decir que tienen sólo átomos de
carbono e
hidrógeno. La
fórmula general para alcanos alifáticos (de cadena lineal) es C
nH
2n+2, y para cicloalcanos es C
nH
2n. También reciben el nombre de
hidrocarburos saturados.
Los alcanos son compuestos formados solo por
átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de
grupos funcionales como el
carbonilo (-CO),
carboxilo (-COOH),
amida (-CON=), etc. La relación C/H es de C
nH
2n+2 siendo n el número de átomos de carbono de la
molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es la causa de su nombre no sistemático:
parafinas (del
latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir,
covalentes por compartición de un par de
electrones en un
orbital s, por lo cual la estructura de un alcano sería de la forma:
donde cada línea representa un enlace covalente. El alcano más sencillo es el
metano con un solo átomo de carbono. Otros alcanos conocidos son el
etano,
propano y el
butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano...
Los
alcanos cíclicos o
cicloalcanos son, como su nombre indica hidrocarburos alcanos de cadena cíclica. En ellos la relación C/H es C
nH
2n). Sus características físicas son similares a las de los alcanos no cíclicos, pero sus características químicas difieren sensiblemente, especialmente aquellos de cadena mas corta, de estos siendo mas similares a las de los
alquinos.
Los alcanos se obtienen mayoritariamente del
petróleo, ya sea directamente o mediante cracking o
pirólisis, esto es, rotura térmica de
moléculas mayores. Son los productos base para la obtención de otros compuestos orgánicos.
NOMENCLATURA
La nomenclatura
IUPAC (forma sistemática de denominar a los compuestos) para los alcanos es el punto de partida para todo el sistema de nomenclatura. Se basa en identificar a las cadenas hidrocarbonadas. Las cadenas de hidrocarburos saturados lineales son nombradas sistemáticamente con un prefijo numérico griego que denota el número de átomos de carbono, y el sufijo "-ano".
Los 4 primeros reciben los nombres de
metano,
etano,
propano y
butano.
TOMADO DE WIKIPEDIA.


 , tiene como dominio, codominio e imagen a todos los
, tiene como dominio, codominio e imagen a todos los 

 tal que
tal que  , en cambio, si bien su dominio y codominio son iguales a
, en cambio, si bien su dominio y codominio son iguales a  , sólo tendrá como imagen los valores comprendidos entre 0 y +
, sólo tendrá como imagen los valores comprendidos entre 0 y + , con
, con 
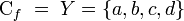

 .
.  con un (y sólo un)
con un (y sólo un)  se denota
se denota  , en lugar de
, en lugar de 

 o
o  . A los elementos del dominio se les llama habitualmente argumento de la función.
. A los elementos del dominio se les llama habitualmente argumento de la función.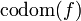 o
o  o
o  o
o 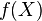 .
.